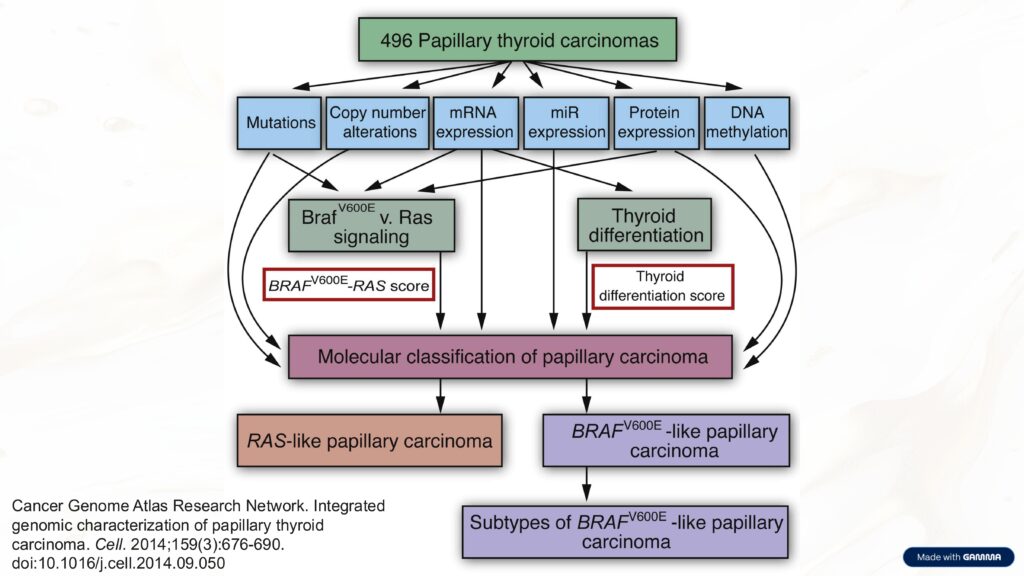
Existen dos grandes grupos de tumores:
- Tumores BRAF-like
Comprenden CPT clásico y variante folicular infiltrante.
Mutación BRAF V600E predominante.
Crecimiento infiltrativo, mayor afectación ganglionar y pérdida temprana de genes de diferenciación tiroidea → menor captación de yodo. - Tumores RAS-like
Incluyen adenomas foliculares, carcinoma folicular y variante folicular encapsulada del CPT.
Crecimiento expansivo con cápsula, diseminación hematógena, conservación de diferenciación → mejor captación de yodo.
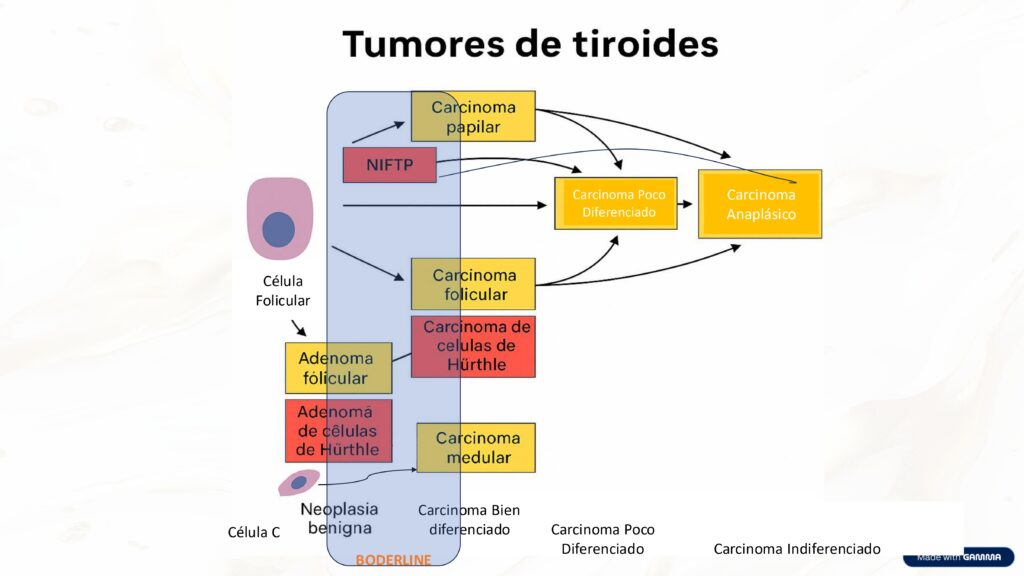
LESIONES PRECURSORAS Y PROGRESION:
La neoplasia tiroidea folicular no invasiva con características nucleares tipo papilar (NIFTP) representa una entidad clínico-patológica importante en el espectro de lesiones tiroideas. Se considera una lesión precursora para la variante folicular encapsulada e invasiva del carcinoma papilar de tiroides.
Esta clasificación refleja nuestra comprensión actualizada del desarrollo secuencial del cáncer de tiroides, donde distintas lesiones precursoras evolucionan hacia carcinomas invasivos siguiendo vías moleculares específicas (tipo BRAF o tipo RAS).
Micro-CPT: puede tener mutaciones BRAF como evento temprano.
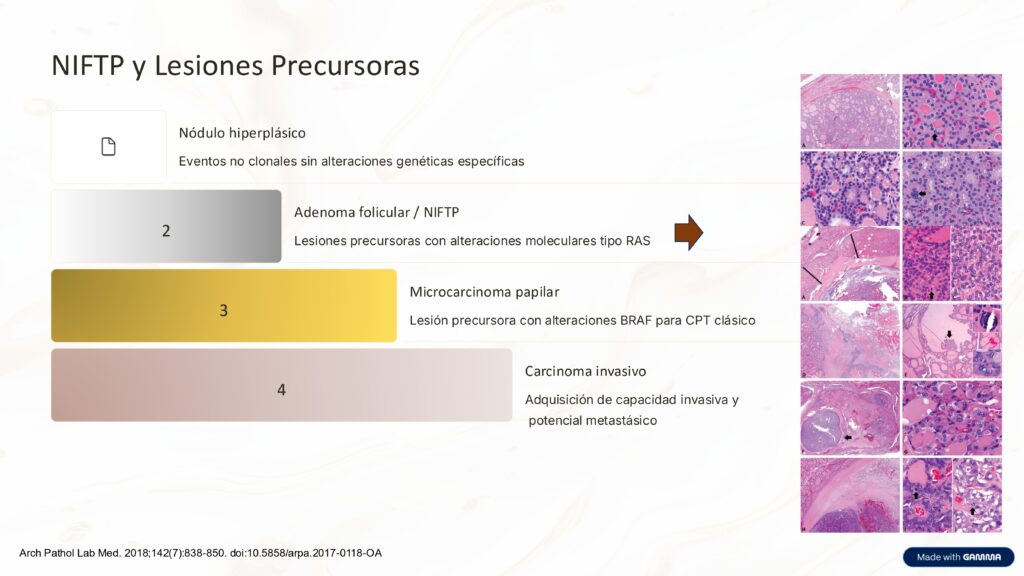
HEAT GENETICOS Y PROGRESION TUMORAL
Como parte de la progresión muchos tumores presentan un segundo “heat” de mutaciones (TERT, TP53, PIK3CA, AKT1) que les confiere mayor agresividad y se asocian a invasión, metástasis y transición a carcinomas poco diferenciado o naplásico.
PUNCION DE NODULOS TIROIDEOS
La Punción-Aspiración con Aguja Fina (PAAF) es un procedimiento esencial para la evaluación de nódulos tiroideos. Su propósito principal es diferenciar entre nódulos benignos y malignos, recolectando células para un análisis citológico detallado. Desde su introducción, la PAAF ha demostrado ser altamente efectiva y costo-efectiva, reduciendo significativamente la necesidad de cirugías para nódulos benignos.
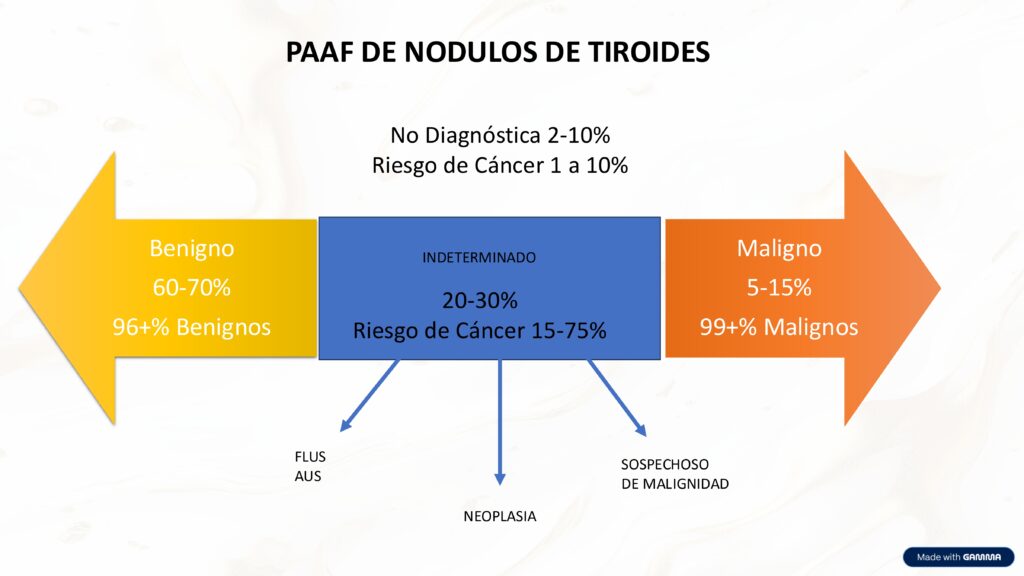
La mayoría de los casos son benignos, sin embargo, entre un 20 a 30% de los resultados caen en una categoría indeterminada, donde el riesgo de malignidad puede variar significativamente, lo que justifica el uso de pruebas moleculares en ciertos casos. Los resultados francamente malignos representan menos del 15%, pero con una alta especificidad diagnóstica.
A pesar de la alta eficacia de la PAAF, un desafío significativo persiste: esto impide una clasificación definitiva entre benigno y maligno solo con la citología. Esto a menudo conduce a cirugías diagnósticas innecesarias, dado que la mayoría de estos nódulos resultan ser benignos. Esto tiene un impacto clínico relevante, ya que muchos pacientes son operados sin un diagnóstico definitivo. Sin embargo, estas muestras ofrecen una oportunidad valiosa: son candidatas ideales para estudios moleculares que pueden orientar mejor la conducta.
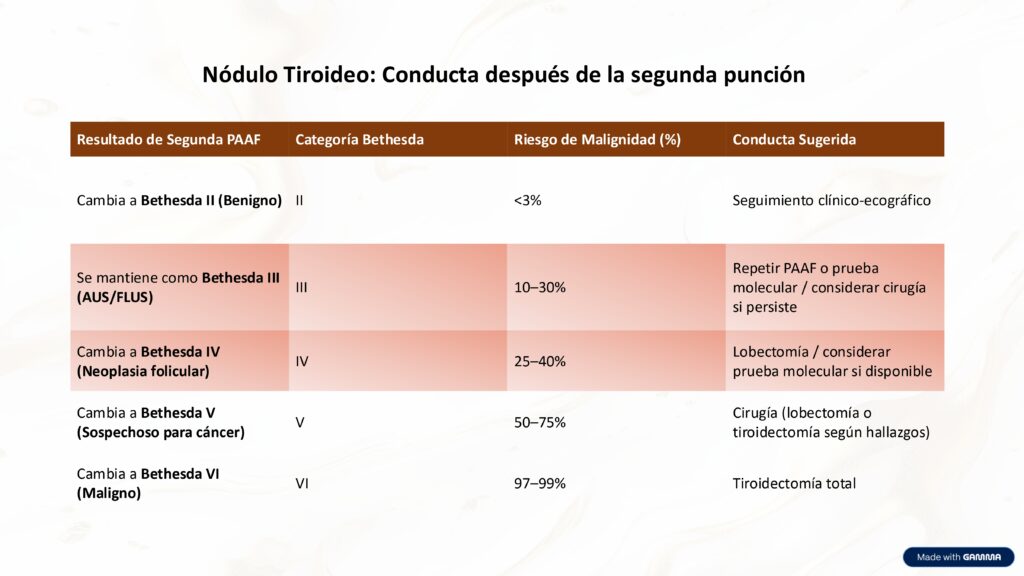
Cuando un nódulo tiroideo es clasificado inicialmente como indeterminado, se debe repetir la punción, esa segunda punción puede orientar claramente la conducta. Si el resultado cambia a benigno, se opta por seguimiento clínico. Si persiste como Bethesda III (Citología Indeterminada), se pueden usar pruebas moleculares o considerar cirugía. A medida que el riesgo de malignidad aumenta en las categorías Bethesda IV, V y VI, la indicación quirúrgica se vuelve más firme, desde lobectomía hasta tiroidectomía total.
PRUEBAS MOLECULARES:
En el contexto de nódulos tiroideos con citología indeterminada (Bethesda III y IV), las pruebas moleculares se han consolidado como herramientas complementarias para estratificar el riesgo de malignidad y guiar la conducta quirúrgica.


ThyroSeq v3 (TM), basado en secuenciación de próxima generación (NGS), evalúa más de 100 genes incluyendo mutaciones puntuales, fusiones, alteraciones en número de copias (CNIs) y perfiles de expresión. Ofrece una sensibilidad cercana al 94% y un VPN (Valor predicitvo negativo) de hasta 97%, lo que permite considerar seguimiento en lugar de cirugía cuando el resultado es negativo.
AFIRMA (TM) GEC/GSC, basado en ARN, identifica patrones de expresión asociados a benignidad. Aunque tiene un rendimiento similar en sensibilidad, su mayor tasa de muestras no evaluables y menor especificidad puede limitar su uso en ciertos escenarios clínicos.
miRInform, menos utilizado actualmente, se basa en perfiles de microARN. Aunque útil, su validación clínica es más limitada.
Estas pruebas son especialmente útiles cuando la cirugía representa un dilema clínico, como en nódulos de gran tamaño, antecedentes familiares, comorbilidades o deseo del paciente de evitar una tiroidectomía innecesaria. En centros con disponibilidad, su uso puede reducir significativamente el número de lobectomías diagnósticas no terapéuticas.
DESAFIOS DE LAS PRUEBAS MOLECULARES.
Aunque las pruebas moleculares han representado un avance significativo en el manejo de nódulos tiroideos indeterminados, su implementación clínica enfrenta múltiples desafíos.
Desde el punto de vista económico, el alto costo y la infraestructura requerida restringen su uso, particularmente en sistemas de salud con recursos limitados. Además, la evidencia sobre su costo-efectividad sigue siendo controversial.
En cuanto a la interpretación, no todas las alteraciones moleculares se correlacionan directamente con malignidad. Mutaciones como RAS pueden encontrarse tanto en neoplasias benignas (como NIFTP) como en carcinomas, generando ambigüedad diagnóstica. Asimismo, muchas mutaciones de alto riesgo aún no son detectadas con plataformas comerciales actuales.
La validación sigue siendo un punto crítico. La ausencia de datos en poblaciones especiales, como pacientes pediátricos, limita su extrapolación. Además, el impacto real sobre decisiones quirúrgicas aún es modesto según la literatura, por lo que se requiere una mejor definición de los escenarios clínicos en los que estas pruebas ofrecen un valor agregado claro. Impacto limitado en la toma de decisiones quirúrgicas: Los estudios han demostrado que solo un pequeño porcentaje de pacientes (7.9% a 8.4%) tuvo una modificación en la decisión quirúrgica como resultado de las pruebas moleculares. Esto subraya la importancia de identificar los escenarios clínicos apropiados donde las pruebas moleculares serían realmente útiles
Es clave seguir refinando estos paneles moleculares para incorporar adecuadamente nuevas entidades como el NIFTP y reducir el sobretratamiento quirúrgico en lesiones de bajo riesgo.
En resumen las mutaciones tipo RAS, presentes en ~60% de algunos paneles, implican un riesgo bajo a intermedio de cáncer bien diferenciado, muchas veces suficiente con lobectomía diagnóstica. La presencia de CNIs asociados a células de Hürthle se considera de riesgo intermedio, y la decisión sobre lobectomía o tiroidectomía dependerá del tamaño del nódulo y hallazgos ecográficos. Las mutaciones tipo BRAF V600E o alteraciones tipo BRAF-like orientan a un carcinoma papilar clásico con riesgo intermedio, siendo un dato determinante para definir la extensión quirúrgica.
Finalmente, las mutaciones de alto riesgo (TERT, TP53, RET/PTC) se asocian a comportamiento biológico agresivo, justificando tiroidectomía total y tratamiento con radioyodo incluso en estadios iniciales.

CONCLUSION:
La clasificación molecular del cáncer de tiroides diferenciado nos permite ahora hablar de tres grupos principales: tumores impulsados por alteraciones tipo BRAF, tumores impulsados por alteraciones tipo RAS, y tumores impulsados por alteraciones del número de copias. Cada grupo presenta características clínico-patológicas distintivas con implicaciones directas para el manejo del paciente.
El conocimiento actual de los eventos genéticos impulsores en la gran mayoría de los cánceres de tiroides nos permite avanzar hacia una medicina de precisión, donde las decisiones terapéuticas se basan en el perfil molecular, predecir la agresividad biológica, el pronóstico, el riesgo de recurrencia y la eficacia del tratamiento, así como para identificar posibles dianas terapéuticas y desarrollar atención personalizada.

